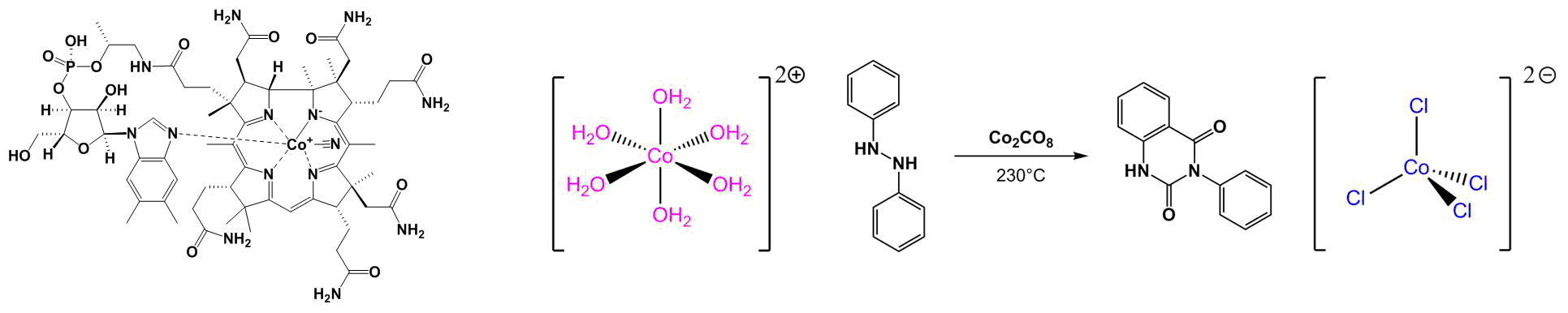
Comparaison des résultats
Coefficients d’absorption molaire
Rappelons les résultats obtenus :
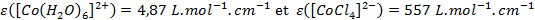
Ces deux valeurs sont très différentes, il y a plus d’un facteur 100 entre elles ! Ces deux complexes n’ont pas les mêmes ligands mais surtout pas la même géométrie. En effet, le coefficient d’extinction molaire dépend directement de la géométrie du complexe. Dans le cas d’un complexe centrosymétrique, la règle de Laporte s’applique. C’est-à-dire qu’une transition entre deux fonctions d’onde de même symétrie est interdite :
Ainsi, une transition entre orbitales d de symétrie g est toujours interdite de symétrie. On en déduit alors que le coefficient d’absorption associé sera relativement faible (entre 1 et 10 mol.L-1.cm-1).
Dans le cas d’un complexe non centrosymétrique, les transitions entre orbitales d sont toujours interdites puisqu'on n'a pas Δl=±1, cependant il n'y a plus l'interdiction de symétrie. Il en résulte donc que les coefficients d’absorption seront plus élevés que pour les complexes centrosymétriques (entre 1 et 1000 L.mol-1.cm-1).
Les deux géométries envisagées pour nos complexes sont la géométrie tétraédrique et la géométrie tétraédrique. D’après les valeurs de nos coefficients d’extinction molaire, on peut en déduire que le complexe aqua est centrosymétrique alors que le complexe chloro ne l’est pas. On en déduit alors que le complexe aqua est en géométrie octaédrique alors que le complexe chloro est en géométrie tétraédrique. Par ailleurs, on peut corréler ce résultat à deux éléments :
- On obtient un paramètre de champ cristallin plus faible pour le complexe chloro que pour le complexe aqua :
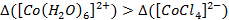
- A partir de ce résultat, on en déduit que les transitions entre orbitales d auront lieu à plus faible énergie dans le complexe tétraédrique que dans le complexe octaédrique. Ainsi, l’absorbance sera déplacée vers les plus hautes longueurs d’onde pour le complexe tétraédrique, c’est-à-dire vers l’orange (700 nm) par rapport au complexe octaédrique (515 nm).

Couleurs complémentaires et absorbance
On en déduit alors que le complexe tétraédrique possédant les ligands chlore absorbe dans le rouge-orange et apparaitra ainsi bleu et que le complexe octaédrique possédant les ligands aqua absorbe dans le vert et apparaitra donc rouge – pourpre/rose. Ce sont bien les couleurs que l’on observe et le complexe tétraédrique a bien une couleur déplacée vers le bleu.
Ionicité de la liaison
Nous avons trouvé les pourcentages d’ionicité suivants :
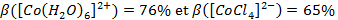
On trouve la liaison cobalt – chlore plus covalente que la liaison cobalt – eau. Ce résultat est en accord avec la différence d’électronégativité entre les atomes car :
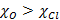
L’oxygène attirant plus les électrons à lui, la liaison en sera d’autant plus ionique. De plus, dans le complexe tétraédrique, les ligands se trouvent plus proche du métal central. Il en résulte alors une interaction plus forte entre l’atome de chlore et l’atome de cobalt et donc une plus forte covalence.
Conclusion
Suite à des manipulations simples de dissolution de solide et de dilution, nous avons obtenu deux complexes en solution que nous avons ensuite étudié par spectroscopie UV-visible. La simple connaissance de ces spectres nous permet d’obtenir un grand nombre de caractéristiques moléculaires de ces complexes. Nous avons pu déterminer le paramètre de champ cristallin, le paramètre de Racah permettant de rendre compte de la répulsion des électrons, l’ionicité des liaisons métal-ligand, ainsi que les coefficients d’extinction molaire, le tout avec une très grande précision. Ces expériences permettent d’illustrer comment de simples informations, comme la longueur d’onde du maximum d’absorption, peuvent permettre d’accéder à des données apparemment difficiles d’accès tout autant qu’à des explications simples pour la couleur de la solution de complexe considérée.