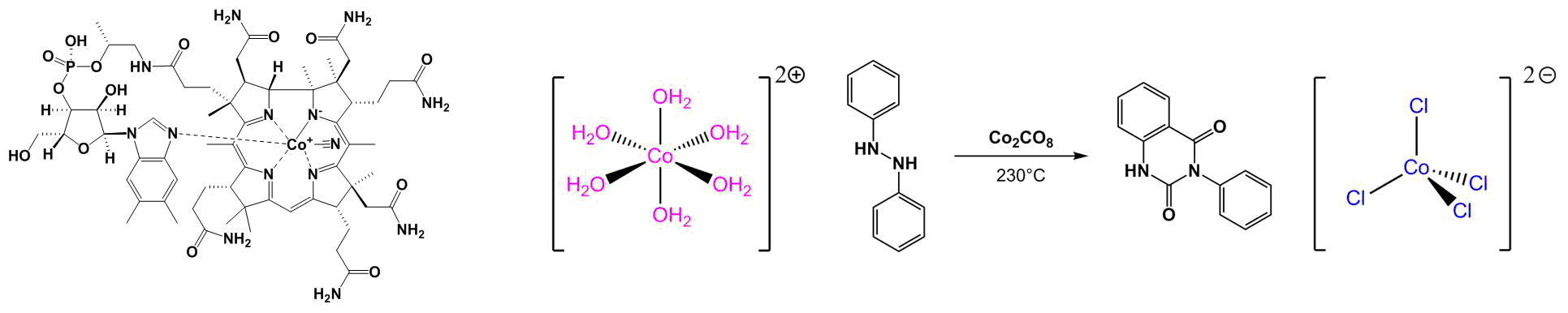
Étude de [CoCl4]2-
Dans cette partie, nous allons essayer d'étudier le complexe [CoCl4]2- de la même façon que le complexe aqua. Pour le former, il faut placer du chlorure de cobalt dans de l'acide chlorhydrique à 37%. On réalise comme pour [Co(H2O)6]2+ des spectres d'absorption pour les solutions formées, mais on doit cette fois se placer à des concentrations inférieures pour ne pas saturer le signal du spectrophotomètre.
Partie expérimentale
Produits
- Chlorure de cobalt hexahydraté (CAS 7791-13-1) ;
- Acide chlorhydrique à 37% (CAS 7647-01-0).
Matériel
- Quatre fioles jaugées de 100 mL ;
- Trois pipettes jaugées de 50 mL ;
- Une balance de précision ;
- Deux béchers de 50 mL ;
- Un spectrophotomètre UV–visible et des cuves en verre.
Mode opératoire
On prépare 4 solutions de [CoCl4]2- de concentrations respectives 3,13.10-4, 6,25.10-4, 1,25.10-3 et 2,5.10-3 mol.L-1. Pour cela, on prélève 62,2 mg de CoCl2 que l’on place dans une fiole jaugée de 100 mL, que l’on remplit ensuite par de l'acide chlorhydrique à 37% jusqu'au trait de jauge. A partir de cette solution, on prépare trois solutions filles par dilution par des facteurs 2, 4 et 8 de la solution mère. Les solutions obtenues sont de couleur bleue de plus en plus foncée à mesure que la concentration augmente.
I - Spectre d'absorption UV-visible et coefficient d'extinction molaire
On enregistre le spectre d’absorption de ces quatre solutions entre 300 et 900 nm. On obtient le graphique suivant :
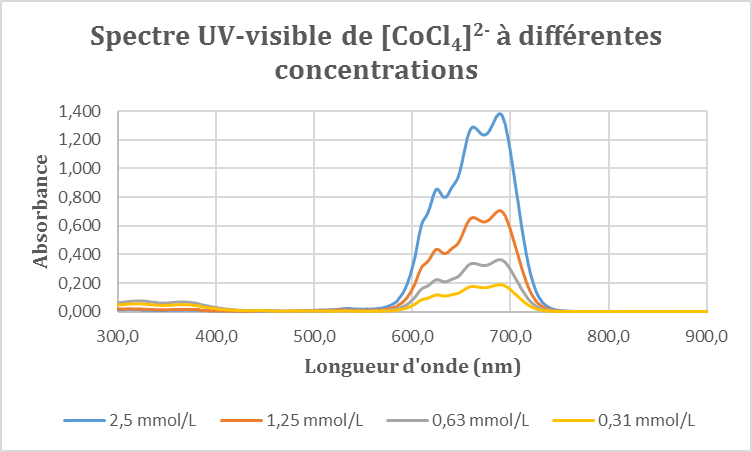
On observe trois pics d’absorbance sur ce diagramme aux longueurs d’onde 625 nm, 662 nm et 689 nm. Nous avons souhaité déterminer le coefficient d’extinction molaire associé au complexe [CoCl4]2-. Pour cela, on se place à 689 nm et on relève l’absorbance correspondantes pour les quatre solutions. D’après la loi de Beer–Lambert, on sait que :
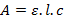
Où :
- A est l’absorbance de la solution sans unité ;
- ε est le coefficient d’extinction molaire en L.mol-1.cm-1 ;
- c est la concentration de la solution en mol.L-1.
Ainsi nous devrions obtenir une droite passant par l’origine dont le coefficient directeur nous permettrait de déterminer le coefficient d’extinction molaire ε.
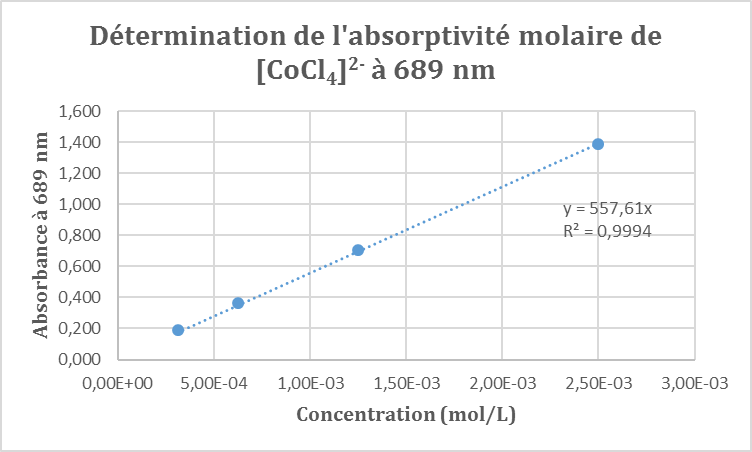
C’est bien le cas : nous obtenons une fonction linéaire avec un très bon coefficient de corrélation. Cela nous permet de déterminer le coefficient d’extinction molaire du complexe :
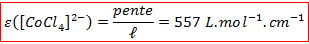
II - Détermination des paramètres du champ cristallin et lien avec le spectre d'absorption
A partir de ces résultats expérimentaux, nous allons pouvoir déterminer les mêmes caractéristiques moléculaires de notre complexe que précédemment. Pour les déterminer, nous allons nous servir du diagramme de Tanabe–Sugano pour un ion d7 en symétrie tétraédrique. Le terme spectroscopique fondamental est le même que tout à l’heure :
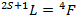
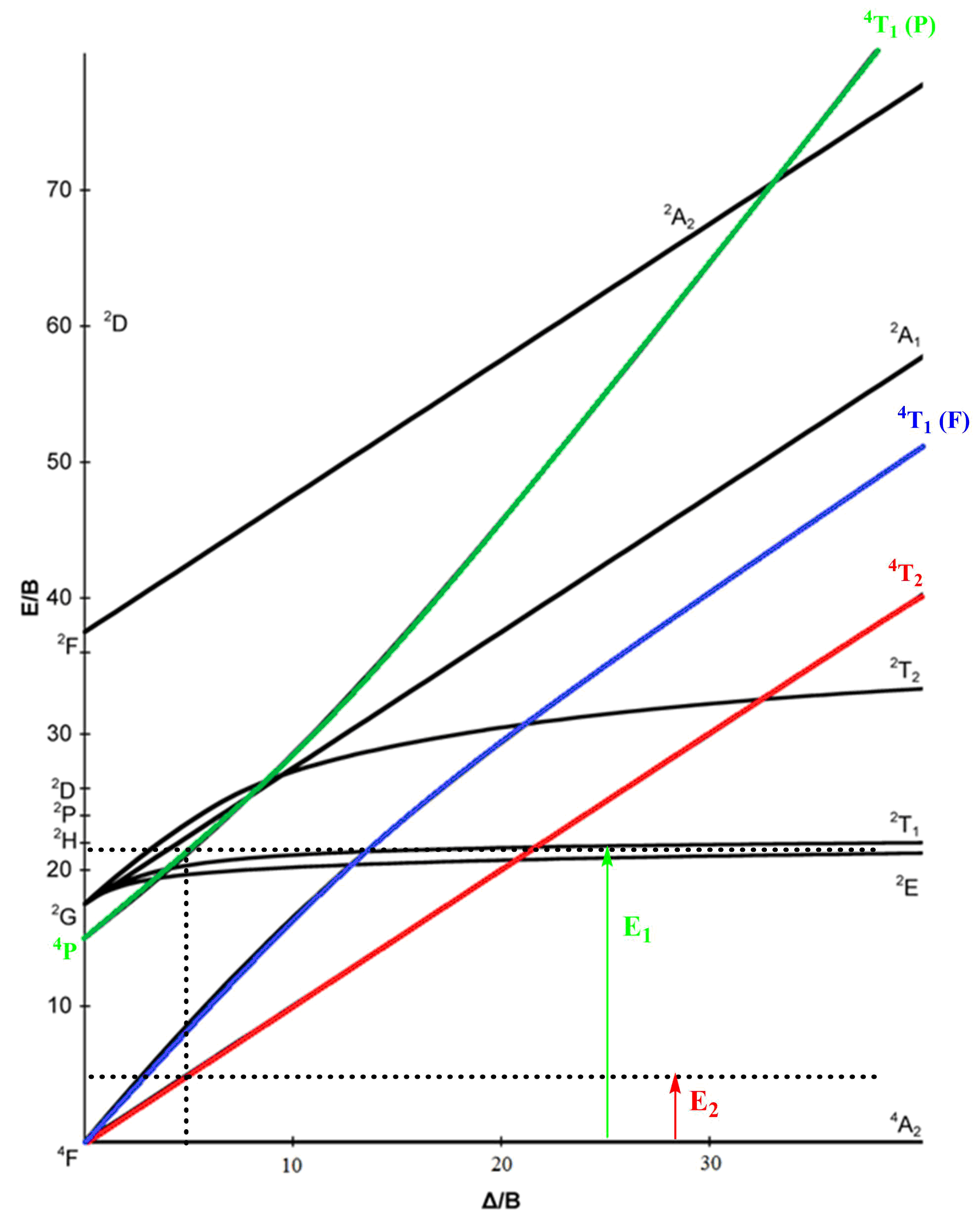
On a repassé en couleur les transitions permises de spin : il en existe trois aussi.
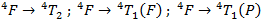
Sachant que l’on observe trois pics sur ce spectre et qu’il est difficile de dire si ce sont trois pics d’absorption différents ou simplement des transitions rovibroniques. Afin de répondre à cette question, nous allons nous placer dans un modèle grossier où lors de la transition de la géométrie octaédrique à la géométrie tétraédrique, nous n’avons pas changé la nature des ligands. Dans ce cas très simple, on a la relation :
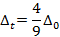
Cependant, on peut affiner ce modèle en prenant en compte le changement de ligand avec le paramètre de Jorgensen f qui vaut 0,78 pour les ions chlorure. Il vaut 1 pour la molécule d’eau. Ainsi, on aura :
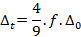
Le paramètre de champ cristallin octaédrique est celui qui a été déterminé dans la partie précédente donc on en déduit :
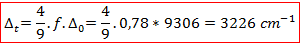
Cette énergie correspond d’après le diagramme de Tanabe–Sugano (c’est la droite correspondant à la première bissectrice) à la transition :
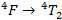
Ce résultat est tout à fait cohérent avec la littérature qui annonce un éclatement du champ tétraédrique de 3300 cm-1. On peut alors en déduire la longueur d’onde à laquelle on devrait obtenir cette transition :
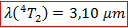
C’est donc encore une transition dans le proche infrarouge que l’on ne peut observer sur notre spectre.
Supposons par exemple que la transition que l’on observe sur notre spectre est la transition :
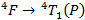
Dans ce cas, en renouvelant la méthode vue dans la partie précédente, on va pouvoir déterminer le rapport du paramètre de champ cristallin sur le paramètre B à partir de la longueur d’onde obtenue ci–dessus. En effet, on lit sur notre spectre que le maximum d’absorption est à 689 nm, on peut donc calculer le rapport des énergies :
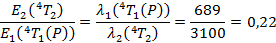
On lit sur le graphique que pour obtenir ce rapport, il faut se placer à :
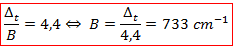
La littérature nous donne ici une valeur de 730 cm-1. On est donc encore extrêmement proche, c’est à nouveau une manipulation donnant lieu à d’excellents résultats. On détermine maintenant l’énergie associée à la transition qu’il nous manque pour conclure :
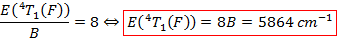
D’où la longueur associée supposée pour l’observation du pic d’absorption correspondant :
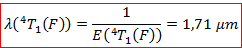
Il est donc là aussi normal de ne pas observer cette transition sur le spectre puisqu’elle se situe à des longueurs d’onde plus hautes que celles que nous avons balayées. Notre hypothèse de base était donc bonne, ce qu’on observe en fait sur ce spectre est une unique bande d’absorption correspondant à la transition :
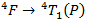
Les autres pics observés ne sont que des transitions associées à la structure rotationnelle et vibrationnelle de la molécule.
On peut de même que tout à l’heure calculer le pourcentage d’ionicité de la liaison :
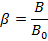
Où B0 est un paramètre théorique connu valant 1120 cm-1. Ainsi on calcule le pourcentage d’ionicité de la liaison :
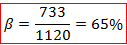
C’est donc une liaison fortement ionique qui relie les ligands au cobalt. Nous pouvons comparer ce résultat avec le pourcentage d’ionicité obtenu par la relation de Pauling à partir des électronégativités du cobalt et du chlore :
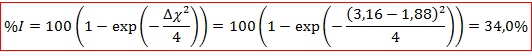
On commence à trouver un écart notable entre les deux modèles. Le modèle de Pauling est cohérent pour des différences d’électronégativité importantes entre les atomes considérés, plus celle–ci diminue, plus nos deux modèles seront incohérents.